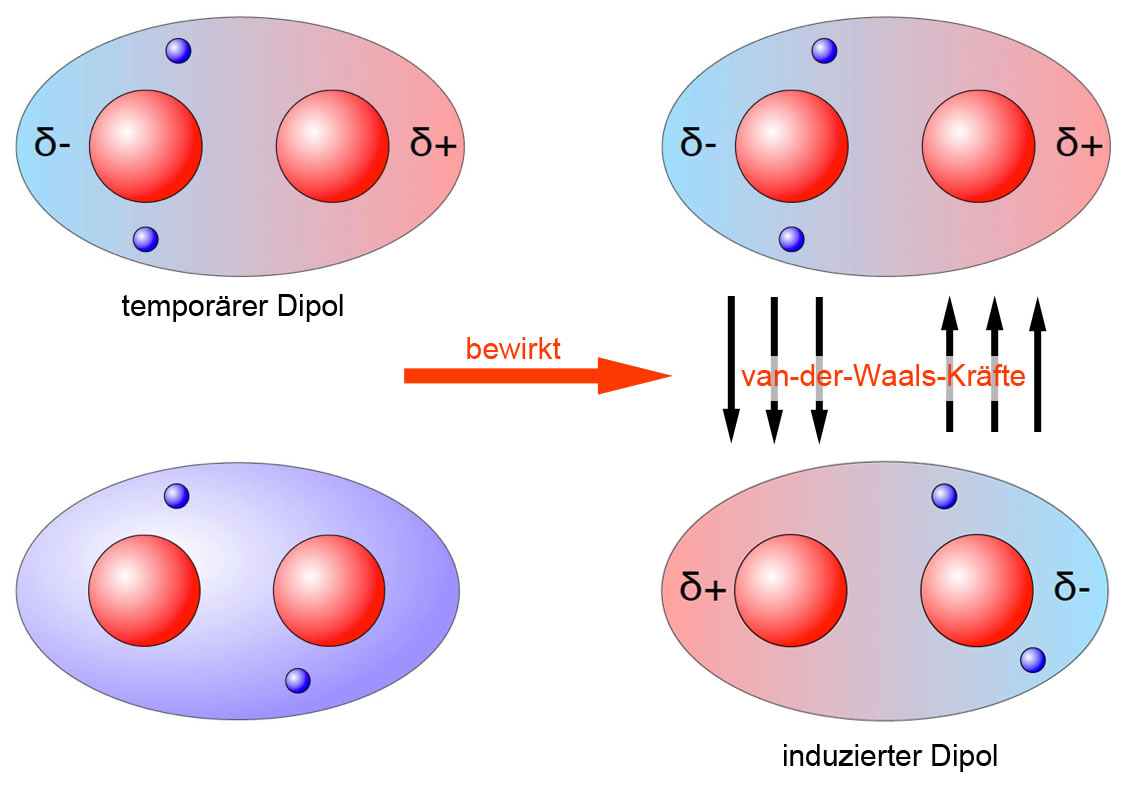
Die Staerke der Bindung dieser vanderWaalsMolekuele ist hundertemal geringer als die gewoehnlicher chemischer Bindungen. Form der Adsorption aufgrund rein physikalischer Anziehung Van-der-Waals-Kraft zwischen dem Adsorbat und der Oberflaeche.
Van Der Waals Bindung - Spaß für meinen eigenen Blog, bei dieser Gelegenheit werde ich Ihnen im Zusammenhang mit erklären Van Der Waals Bindung. Also, wenn Sie großartige Aufnahmen machen möchten Van Der Waals Bindung, Klicken Sie einfach auf das Speichersymbol, um das Foto auf Ihrem Computer zu speichern. Sie können heruntergeladen werden. Wenn Sie möchten und möchten, klicken Sie im Beitrag auf "Logo speichern". Der Download erfolgt direkt auf Ihren Heimcomputer.
Van Der Waals Bindung ist eine wichtige Information, die von Fotos und HD-Bildern begleitet wird, die von allen Websites der Welt stammen. Laden Sie dieses Bild kostenlos in High Definition-Auflösung mit der unten stehenden Option "Download-Schaltfläche" herunter. Wenn Sie nicht die genaue Auflösung finden, nach der Sie suchen, wählen Sie Original oder eine höhere Auflösung. Sie können diese Seite auch einfach speichern, sodass Sie sie jederzeit anzeigen können.
Hier sind Sie auf unserer Website, Inhalt oben, veröffentlicht von Babang Tampan. Wir hoffen du genieße behalte hier. Für einige Updates und Neueste Informationen zum folgenden Foto folgen Sie uns bitte auf Twitter, Pfad, Instagram, oder Sie markieren diese Seite auf Lesezeichen Abschnitt, Wir versuchen zu bieten update regelmäßig mit frisch und neu Aufnahmen, liebe dein Surfen und finde das Ideal für dich. Heute Wir sind erfreut, anzukündigen dass wir gefunden ein extremes interessanter Nische, der besprochen, viele Leute suchen Einzelheiten von zu finden, und natürlich einer von diesen bist du, nicht wahr?
 Organische Chemie Fur Schuler Vertiefung Wikibooks Sammlung Freier Lehr Sach Und Fachbucher
Organische Chemie Fur Schuler Vertiefung Wikibooks Sammlung Freier Lehr Sach Und Fachbucher
However the 12-10 form of this expression n 12 m 10 can be used to model hydrogen bonds see Modeling Hydrogen Bonds below.
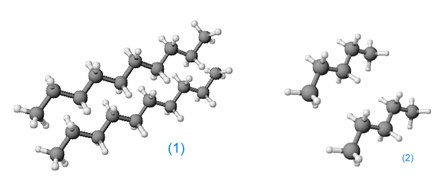
Van der waals bindung. Typically the 12-6 Lennard-Jones parameters n 12 m 6 are used to model the Van der Waals forces 1 experienced between two instantaneous dipoles. Einige intermolekulare Kraefte sind staerker und andere sind schwach. Alle Van-der-Waals-Kraefte sind im Vergleich zur kovalenten Bindung und Ionenbindung schwache Kraefte wobei die Dispersionswechselwirkung im Allgemeinen der dominierende der drei Bestandteile ist.
Aus den Untersuchungen gehen Informationen ueber die Struktur und Stabilitaet solcher Spezies hervor und sie ermoeglichen neue Einblicke in die Natur schwacher intermolekularer Wechselwirkungen. Bei welchen Molekuelen sind die Van-der-Waa. Van der Waals gegen Wasserstoffbruecken Van-der-Waals-Kraefte und Wasserstoffbruecken sind intermolekulare Anziehungspunkte zwischen Molekuelen.
Die Bindung geschieht durch leichte physikalische Kraefte van der Waals-Kraft und kann durch aeussere Einfluesse. Eigentlich ist die Van der Waals Bindung keine echte Bindung wird aber meistens als eine solche bezeichnetSie besteht zwischen fast allen Teilchen wird hauptsaechlich aber durch staerkere Bindungsarten ueberdeckt. Die Van-der-Waals Bindung Auftreten und Nutzen Chemie Referat von Lauritz Jonas und Niko Zusammenfassung Zusammenfassung Die Van-Der-Waals-Bindung ist eine schwache Anziehungskraft zwischen 2 AtomenMolekuelen.
Van-der-Waals-Bindung Da die besagten Dipolmomente sehr klein sind ist die resultierende elektrische Anziehung sehr schwach und hat nur eine aeusserst geringe Reichweite. In molecular physics the Van der Waals force named after Dutch physicist Johannes Diderik van der Waals is a distance-dependent interaction between atoms or moleculesUnlike ionic or covalent bonds these attractions do not result from a chemical electronic bond. Diese Bindungen bestimmen das Verhalten von Molekuelen.
Alles von uns zum Thema. Van der Waals bond translation in English - German Reverso dictionary see also WaleswalrusWAAFwalkies examples definition conjugation. Beispielsweise nehmen die Van-der-Waals-Kraefte von Chlorwasserstoff bis Iodwasserstoff zu obwohl das Dipolmoment abnimmt.
WERDE EINSER SCHUeLER UND KLICK HIERhttpswwwthesimpleclubdegoDirekt zum Remake Aufgaben. Mit zunehmender molarer Masse nimmt der Siedepunkt zu. Die Edelgasatome die eigentlich keinen Grund haben irgendwelche Bindungen einzugehen werden aufgrund der Van-der-Waals-Bindung bei tiefen Temperaturen fluessig.
HttpbitlyVDWKraefteWie klebt der Gecko an der Wand oder. Dazu zaehlen unter anderem Dipol-Dipol-Wechselwirkungen in Wasser oder die Ionenbindung Eine bessere Bezeichnung fuer diese Situation bietet die Van der Waals Wechselwirkung. Die van der Waals-Kraft oder van der Waals-Wechselwirkung nach niederlaendischen Wissenschaftlers Johannes Diderik van der Waals benannt wurde ist die Summe der anziehenden oder abstossenden Kraefte zwischen den Molekuelen oder zwischen Teilen des gleichen Molekuels andere als die durch kovalente.
So funktioniert sie Grafik 1 Auftreten Auftreten Auf molekularer Ebene. Alle Van-der-Waals-Kraefte sind im Vergleich zur kovalenten Bindung und Ionenbindung schwache Kraefte wobei die Dispersionswechselwirkung im Allgemeinen der dominierende der drei Bestandteile ist. Van der Waals-Bindung - lange Version.
Die VAN DER WAALS-Wechselwirkung Krossing Ingo Steudel Yana Steudel Ralf. With Krossing Ingo Steudel Yana. Van-der-Waals-Bindungen Die schwaechste der Bindungen ist die Van-der-Waals-Bindung.
See all formats and pricing eBook PDF. Van-der-Waals- Bindungen werden auch als Anziehungskraefte zwischen unpolaren Molekuelen bezeichnet. Sie haben eine Bindungsstaerke von 05 - 5 kJmol und stellen diesbezueglich das Schlusslicht aller Bindungen dar.
Fuer die Haftung der Partikel sind neben. This is a combination of electrostatic forces of attraction van-der-Waals forces capillary forces and mechanical clinging between the gripper and object. Get Access to Full Text.
Van-der-Waals-Bindungen koennen auch Festkoerper zusammenhalten. Auch bei Isomeren steigt der Siedepunkt je mehr die Kettenform angenommen wird. 3000 4200 2300.
They are comparatively weak and therefore more susceptible to disturbanceThe Van der Waals force quickly vanishes at longer. Der Einfluss der Van-der-Waals-Kraefte laesst sich am Beispiel der Alkanen verdeutlichen. Zwischen diesen entsteht keine chemische Bindung.
You can also find us at. Ein Beispiel dafuer sind die Edelgaskristalle die nur bei sehr tiefen Temperaturen vorkommen. Damit die Van-der-Waals-Bindung ueberhaupt zustande kommen kann muessen sich zwei Atome beziehungsweise Molekuele also sehr nahe kommen.
Chemie der Nichtmetalle Von Struktur und Bindung zur Anwendung Chemistry of Non-metals In coop.
 Van Der Waals Krafte Bindungen Gehe Auf Simpleclub De Go Werde Einserschuler Youtube
Van Der Waals Krafte Bindungen Gehe Auf Simpleclub De Go Werde Einserschuler Youtube
 Van Der Waals Krafte Erklart Inkl Ubungen
Van Der Waals Krafte Erklart Inkl Ubungen
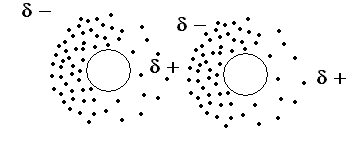 Prof Blumes Medienangebot Chemie Der Kohlenwasserstoffe
Prof Blumes Medienangebot Chemie Der Kohlenwasserstoffe
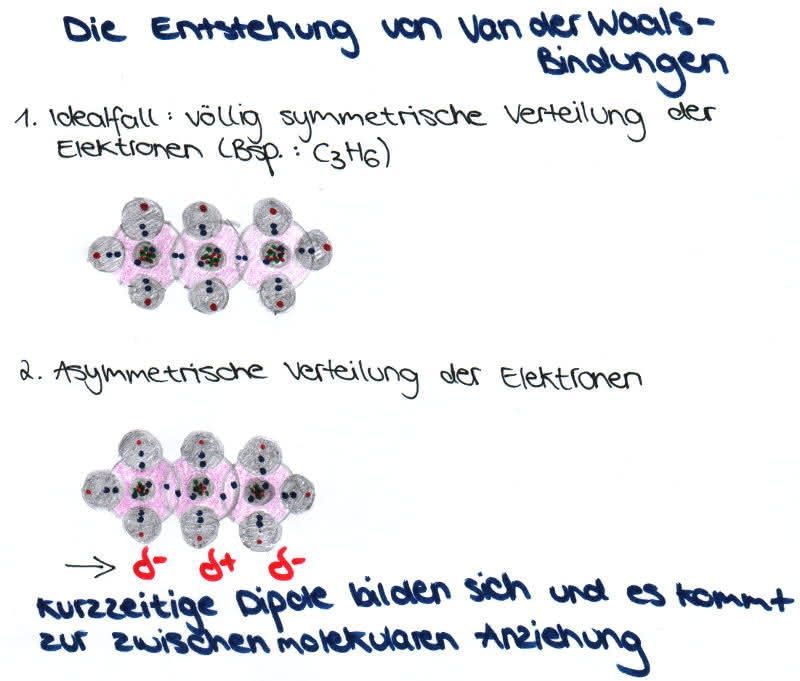 Organische Chemie Zwischenmolekulare Krafte Und Anziehungskrafte Zwischen Molekulen
Organische Chemie Zwischenmolekulare Krafte Und Anziehungskrafte Zwischen Molekulen
 Van Der Waals Krafte Definition Beispiel Mit Video
Van Der Waals Krafte Definition Beispiel Mit Video
 Van Der Wals Krafte Chemische Bindungen Youtube
Van Der Wals Krafte Chemische Bindungen Youtube
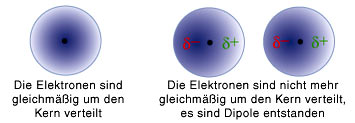 Die Van Der Waals Kraft Anziehung Durch Quanteneffekte Hier Wohnen Drachen
Die Van Der Waals Kraft Anziehung Durch Quanteneffekte Hier Wohnen Drachen
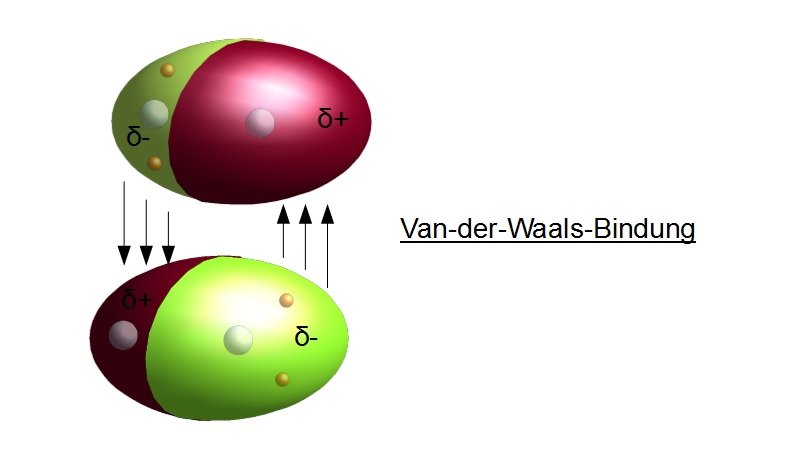 Van Der Waals Sche Bindung Werkstofftechnik 1
Van Der Waals Sche Bindung Werkstofftechnik 1
 Van Der Waals Bindung Lexikon Der Geowissenschaften
Van Der Waals Bindung Lexikon Der Geowissenschaften
 Van Der Waals Krafte Chemiezauber De
Van Der Waals Krafte Chemiezauber De
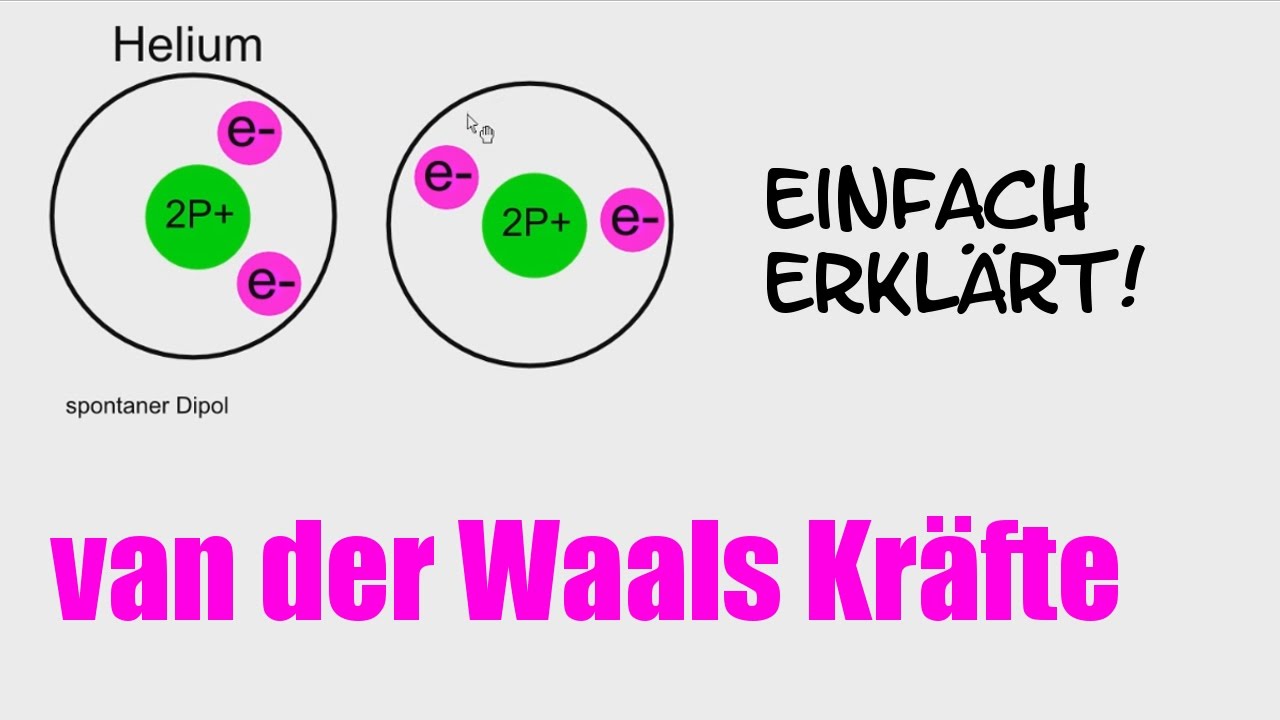 Chemie Van Der Waals Krafte Dipole Erklarung Nachhilfe Tutorial Hd German Deutsch Youtube
Chemie Van Der Waals Krafte Dipole Erklarung Nachhilfe Tutorial Hd German Deutsch Youtube
 Aggregatzustande Im Teilchenmodell Ppt Video Online Herunterladen
Aggregatzustande Im Teilchenmodell Ppt Video Online Herunterladen
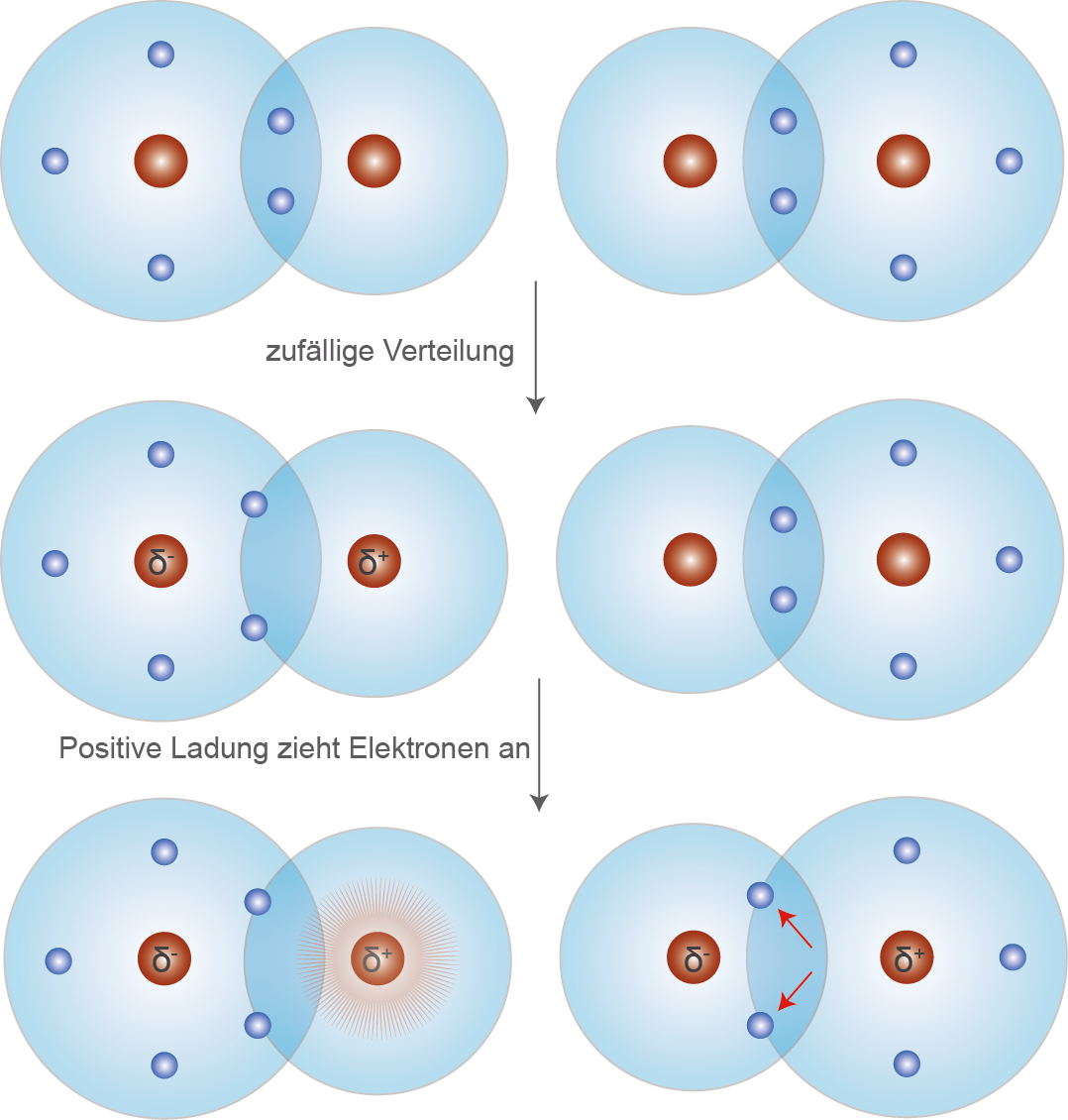 Schullv Dein Digitales Lernverzeichnis
Schullv Dein Digitales Lernverzeichnis